CONDILOMAS (VERRUGAS GENITALES). PERCY ZAPATA MENDO.
CONDILOMAS
(VERRUGAS GENITALES)
1.- Introducción
Las
verrugas genitales (condilomas o condiloma acuminata) son una enfermedad de
transmisión sexual altamente contagiosa, producida por el virus del papiloma
humano (VPH). Se transfiere al mantener relaciones sexuales por vía oral,
genital o anal con un compañero infectado.
En
las mujeres, las verrugas se presentan en las partes interior y exterior de la
vagina, en la abertura (cérvix) hacia el vientre (útero) o alrededor del ano.
En los hombres, las verrugas genitales son menos comunes. En caso de
presentarlas, se pueden observar generalmente en la cabeza del pene. También se
pueden encontrar en el cuerpo de este, en el escroto o alrededor del ano. Se da
el caso, poco común, que se presentan verrugas genitales en la boca o garganta
de un individuo que ha practicado sexo oral con una persona infectada.
Los
condilomas se presentan a menudo en aglomeraciones y pueden ser muy pequeñas o
pueden extenderse en grandes masas sobre el área genital o anal.
Hasta
el momento actual, han sido identificadas más de 100 variantes de este virus.
De ellos, solamente 30 son capaces de infectar el tracto genital.
En
los últimos años, su protagonismo es creciente dada la clara relación existente
entre estos virus el cáncer de cuello de útero en la mujer. Pero tan frecuente
y temido como el primero, lo es cáncer de ano en los varones, especialmente en
la población homosexual masculina.
La
incidencia de carcinoma de células escamosas de ano en los varones
estadounidenses es de 0.7/100.000 habitantes, pero es hasta 35 veces más
frecuente entre varones homosexuales, alcanzando tasas de 35 casos /100.000
habitantes. Dicha cifra alcanza los 90/100.000 si son pacientes homosexuales y
con SIDA.
Otros
estudios estiman que del 50 al 80% de las mujeres pueden llegar a ser
infectadas con VPH a lo largo de su vida. Más del 80% de las infecciones por
VPH son pasajeras, sin síntomas y se resuelven espontáneamente. Otras pueden
progresar a cáncer cervicouterino, ya que este cáncer es causado por una
infección persistente por VPH. Se ha descrito dos picos de edad en el
desarrollo de cáncer cervicouterino: en la adolescencia y entre los 40 a 50
años. El hombre, aunque también puede infectarse con el virus VPH, solo en
raras ocasiones desarrolla cáncer genital.
En
el caso del Perú, un reciente estudio realizado a nivel nacional reveló que
cerca de 300,000 mujeres en Lima Metropolitana se encuentran infectadas con el
Virus del Papiloma Humano (VPH), estando en riesgo elevado de desarrollar cáncer
de cuello uterino, vulva, ano, y otras partes del cuerpo.
Al
respecto, Manuel Álvarez Larraondo, director y gerente de OncoPrev
Internacional en nuestro país, señaló que aproximadamente el 17% de las mujeres
mayores de 25 años tienen actualmente dicho virus.
Por
ello, el especialista indicó que es importante realizarse una evaluación por
personal entrenado, así como tener al alcance pruebas modernas que puedan
detectar la presencia del VPH, “puesto que ya se ha demostrado que el
Papanicolaou no es 100% efectivo”.
Asimismo,
José Jerónimo Guibovich, director de OncoPrev Internacional, aseguró que un
número significativo de estas mujeres infectadas ya estarían presentando
cambios pre-cancerosos que requieren ser detectados y tratados a la brevedad
para evitar que desarrollen un cáncer.
La
capacidad de desarrollar un cáncer, ya sea de útero en la mujer o de ano en el
varón está directamente conexa con el genotipo concreto de HPV que infecta al
huésped. Sabemos que hay dos grupos de virus. Los de bajo riesgo oncogénico y
los de alto riesgo. Los de bajo riesgo en general son responsables de la
aparición de lesiones externas (verrugas genitales comunes) y no suponen un
peligro oncológico para el paciente. Los de alto riesgo en cambio se asocian
con la aparición de displasias epiteliales, neoplasias ano genitales como el
carcinoma in situ de ano, la enfermedad de Bowen genital, el cáncer de cuello
uterino, cáncer de vulva y cáncer de pene en el varón. Por ello, cuando un
paciente está infectado por un HPV, es de vital importancia saber qué tipo de
genotipo ha colonizado al paciente para ajustar los plazos de revisión
pertinentes.
·
Son HPVs de bajo
riesgo los serotipos: 6, 11, 40, 42, 43, 44, 54, 61, 72, y 81
·
Son HPVs de alto
riesgo los serotipos: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 59, 68, 73, y 82.
2.- Breve Historia de las Enfermedades
de Transmisión Sexual
Los
grandes conquistadores romanos, especialmente sus legionarios que tenían los
primeros contactos con las poblaciones que tomaban, las denominaban "morbus incidens" y cuando
realizaban sus invasiones ya usaban unos preservativos hechos de tripa de
carnero que un pastor anónimo los denominó la "camisa de Venus".
Las
escrituras del viejo testamento (Levíticos. Cap. 15) se refieren a la gonorrea
como algo impuro. A fines del siglo XVI Jacques de Béthencourt las denominaba "enfermedades venéreas" (por
lo relativo a Venus, la diosa del Amor).
Posteriormente
Siboulei emplea una expresión menos pre sentenciosa al nombrarlas como "efectos colaterales del amor".
A
lo largo de la historia, muchos personajes, artistas, miembros de la realeza,
militares y otros, cayeron víctimas de estas enfermedades que en ese entonces
eran fatales.
Con
la venida del microscopio, se hizo viable la identificación de los microbios
causantes de estas afecciones, dando un gran paso en el conocimiento de estas
enfermedades.
Pero
fue después de la segunda guerra mundial, con la llegada de los antibióticos
que se pudieron controlar varias de estas molestias, principalmente la sífilis,
que de mortal paso a ser curable, se dio un paso importante en su control y
propagación…hasta las dos décadas que vinieron después…
Durante
los años 60 del siglo XX, el movimiento social liderado por los jóvenes
promueve una serie de cambios en el comportamiento social y sexual (“haz el
amor y no la guerra”), como consecuencia, se abren las puertas a la
promiscuidad y al intercambio de parejas, con el consiguiente incremento de
casos de estas enfermedades derivadas del sexo indiscriminado y sin
precauciones. Es la época del amor libre.
Además,
se encuentran disponibles las píldoras anticonceptivas que permitieron liberar aún
más las actividades sexuales sin el temor a los embarazos no deseados.
La
homosexualidad se establece en grupos sociales que pasan a luchar por sus
derechos en una serie de manifestaciones públicas y explícitas, y presionan con
éxito, para que en muchos lugares se instituyan el “Día del Orgullo Gay”. Acompañando a todos esos eventos, resurgen
nuevamente y de forma epidémica las "enfermedades venéreas",
especialmente, el no muy reciente Virus de la Inmunodeficiencia Humana,
causante del mortal SIDA (recordemos que los primeros casos se dieron en
homosexuales de San Francisco, por lo que se le llamó inicialmente como “Peste
Rosa”).
Hará
unas dos décadas, se ha adoptado el nombre de Enfermedades de Transmisión
sexual (ETS) para agrupar a estas molestias que tienen en las relaciones
íntimas, su principal forma de contagio.
3.- Estructura del VPH
Los
papiloma virus (PV) son virus de DNA icosahédricos pequeños, sin envoltura.
Cada virión tiene entre 52 y 55 mm de diámetro y contiene solo una copia de DNA
viral circular, de doble filamento, cerrado de manera covalente. El genoma de
PV tiene un tamaño de 7 200 a 8 000 pares de bases (bp) y está encapsulado en
una cápside proteínica esférica gruesa, de 2nm de espesor.
La
cápside de PV está compuesta de L1 y L2 (L, del inglés late, o regiones
tardías), la proteína estructural mayor (1) y menor (2), respectivamente que
son codificadas por los genes virales tardíos. Debido a que L2 se encuentra en
cantidades pequeñas, se piensa que la mayor parte de los capsómeros pequeños de
la cápside de PV contiene cinco moléculas de
L1.
Aun
no se aclara el sitio exacto de L2 de la cápside viral, al parecer, para el
ensamble (montaje) del virus no se requiere la expresión de L2, porque los
monómeros L1 expresados sintéticamente se ensamblan de manera espontánea dentro
de la partícula semejante a virus (virus – like particles, VLP) que son
morfológicamente similares a viriones auténticos en la microscopía electrónica.
No obstante, la expresión concurrente de L2 incrementa la productividad y
estabilidad del VLP y se requiere para el empacamiento eficiente de DNA. Debido
a que la cápside no está envuelta, los viriones de PV son resistentes a la
desecación. La estabilidad de los PV también puede aumentar por la protección
de viriones dentro de los núcleos de escamas desprendidas.
Todos
los genomas de PV tienen un patrón de organización en común. Un filamento de
DNA de PV contiene todos los marcos de lectura abiertos (open reading frames,
ORF) o segmentos de codificación del gen (8 para HPV 16,9 para HPV 11 y 10 para
BPV). A través de padrones complejos de empalme del gen, estos ORF codifican
todas las proteínas virales. La región temprana (early, E) del genoma se
transcribe antes y también durante la síntesis de DNA viral.
Esta
región se identificó originalmente como el fragmento específico del genoma de
PBV1 suficiente para la transformación celular, y la región análoga en todos
los genomas de PV se denominó subsecuentemente región temprana. Es posible
detectar productos tempranos del gen dentro de zonas proliferativas de la mayor
parte de lesiones por papiloma virus humano. La región tardía (L, del inglés
late) del genoma contiene los ORF L1 y L2 que, a diferencia de los genes
tempranos, solo se expresan en infecciones virales productivas en las cuales
los productos génicos se restringen a células epiteliales supra basales en
diferenciación. En conjunto, entre los PV se conservan el tamaño y la
localización de la mayor parte de los ORF y también las funciones de las
proteínas virales.
4.- Ciclo de Vida del Virus
El
papiloma virus humano puede unirse a una amplia variedad de células de tejidos
humanos; sin embargo, se une mucho más a células epiteliales y mesenquimatosas.
Alrededor de 50% de los HPV identificados a la fecha infectan superficies
epiteliales, en tanto que el resto se dirige preferentemente al epitelio mucoso
del tubo ano genital. El ciclo de vida de PV está vinculado rigurosamente a la
diferenciación del queratinocito, la célula huésped de la infección. Las
investigaciones sobre el ciclo de vida de VP productivos se han visto
obstaculizadas por el requisito de la diferencia aunado a la falta de
diferenciación completa del queratinocito en cultivo celular cuando no se
efectúa manipulación especial. Por fortuna, hoy en día se cuenta con sistemas in vivo e in Vitro que facilitan la investigación del ciclo de
vida del virus en su totalidad.
El
conocimiento actual sugiere que se diseminan viriones de PV de superficie
epiteliales infectadas dentro de los núcleos de escama muy queratinizadas,
metabólicamente inertes. La infección por PV se hará efectiva solamente si hay
acceso a células epiteliales basales en división activa y es probable que la
faciliten micro abrasiones. La fibrinólisis, que ocurre de manera ordinaria
durante la cicatrización, puede facilitar la disolución de la escama infectada,
con el depósito subsecuente de virus libres en la capa de células basales.
Se
desconoce en gran parte el mecanismo por el cual penetran los PV en las células
blanco o de destino. Varios estudios proporcionaron pruebas de la presencia de
uno o más receptores de PV en la superficie celular. Dos moléculas de
superficie celular que pueden facilitar la unión de PV a células huésped son la
subunidad de integridad y el sulfato de
heparán. La replicación del papiloma virus ocurre en su totalidad dentro del
núcleo de la célula huésped. Durante la penetración viral a queratinocitos
basales, se inicia la expresión viral temprana. A continuación, la máquina de
replicación del DNA de la célula huésped, aunada a las proteínas virales E1 y
E2, facilita la replicación de genoma viral episómico a una cifra baja de
copias ( 20 a 100 por célula ).Célula cervical infectada por Virus del Papiloma
Humano
Durante
la división mitótica de la célula basal infectada, se reparte cerca de 50% de
los episomas de DNA viral a la célula hija, que subsecuentemente se desplaza
hacia la capa espinosa y comienza a diferenciarse. Los genomas
restantes permanecen dentro de la célula madre basal infectada.
Al continuar la diferenciación, el genoma
episómico da copias (200 a 1000 por célula), en preparación para la producción de viriones de progenie. La transcripción
tardía de genes virales se inicia en las capas epiteliales supra basales, mas
diferenciadas. A continuación se producen las proteínas de la cápside viral L1y L2
y facilitan el empacamiento de genomas virales. Por último, se forman
escamas cornificadas que contienen el virus.
Las
infecciones por PV no siempre dan por resultado la producción de viriones de
progenie. En algunos casos es posible detectar DNA de HPV, pero no RNA de HPV,
que representa un estado de aparente latencia clínica. Es común, en especial en
tejidos de algunos tipos, como el epitelio genital, encontrar DNA de HPV en
ausencia de virus infeccioso o en muestras
de histopatología. Es posible que ocurra reactivación de estas
infecciones, con la producción subsecuente de virus. No se comprenden
debidamente los mecanismos de latencia y reactivación de HPV. Las lesiones
benignas inducidas por HPV pueden avanzar a carcinoma, que con frecuencia
coincide con la integración del genoma del papiloma virus dentro del DNA huésped
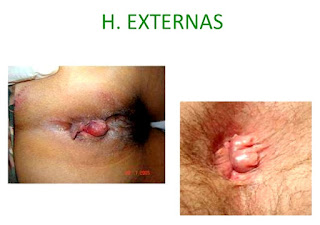
5.- Síntomas
·
Lesiones elevadas
de coloración carnosa en los genitales, ano o piel circundante
·
Crecimientos con
apariencia de coliflor o racimo de uvas alrededor del ano o genitales
·
Acentuación de la
humedad en el área de los crecimientos
·
Picazón del pene,
escroto, área anal o prurito vulvar
·
Aumento del flujo
vaginal
·
Sangrado vaginal
anormal (no asociado con un período menstrual) después de tener relaciones
sexuales
No
obstante, también es frecuente que no haya síntomas.
6.- Diagnóstico
Cualquier
médico o personal de salud puede diagnosticar la infección con sólo observarlas
en un paciente. Las mujeres con verrugas genitales deben someterse también a un
examen para detectar posibles verrugas en el cuello uterino. Hay evidencia de
que la infección por el VPH causa cáncer cérvicouterino.
El
médico puede identificar verrugas en tejido genital, que de otro modo serían
invisibles, mediante la aplicación de vinagre (ácido acético) sobre áreas en
que se sospeche la presencia de infección. Esta medida provoca que las áreas
infectadas se tornen blancuzcas, lo que las hace más visibles, más aún si se
realiza un procedimiento llamado colposcopia. Durante la colposcopia, el médico
usa una lente de aumento para examinar la vagina y cérvix. En algunos casos, el
doctor toma una muestra de tejido del cuello uterino (biopsia) y la examina al
microscopio.
Una
prueba de Papanicolaou también puede indicar la posible presencia de una infección
cervical por VPH. En este examen, se examina células tomadas del cérvix bajo el
microscopio para ver si son cancerosas. Si el Papanicolaou de una mujer arroja
resultados anormales, es probable que esta tenga una infección por VPH. De
ocurrir esto, deberán llevarse a cabo exámenes posteriores para detectar y
tratar cualquier problema cervical.
La
identificación del tipo de HPV es muy importante para establecer el pronóstico
y los controles médicos adecuados. Mediante la captura de híbridos de ácido nucleico
podemos confirmar la presencia del HPV en el paciente, pero no determinar su
genotipo concreto. Hoy el método de elección es la PCR (Polimerasa Chain
Reaction), permite la detección del ADN y los genotipos virales.
7.- Tratamiento para los condilomas
El
tratamiento de los condilomas viene condicionado por varios factores:
1.
Tamaño,
localización y extensión de las lesiones.
2.
Tiempo de
evolución de la enfermedad.
3.
Respuesta a
tratamientos previos.
4.
Estado
inmunológico del paciente.
5.
Coste.
6.
Y lo más
relevante, el potencial oncogénico de la infección viral.
Agentes tópicos
·
La resina de
Podofilino (comercialmente Wartec). Se trata de una sustancia abrasiva que
destruye por contacto el virus pero también daña seriamente la piel sana. Puede
producir importantes quemaduras. Debe de usarse siempre con cautela ajustando
bien la zona a tratar y protegiendo las zonas sanas adyacentes con vaselina.
·
Imiquimod
(comercialmente Imimore). Se trata de un revolucionario tratamiento, apto para
curar superficies amplias (región perineal). Favorece la respuesta inmunológica
local mediante la producción de citoquinas como el Interferón Alfa.
·
5 Fluorouracilo
al 5% en vaselina: fármaco citostático. Obtiene muy buenos resultados.
Inconvenientes: es tóxico y no se encuentra comercialmente en nuestro país. Hay
que formularlo. Nosotros disponemos de él.
·
Acido bi y
tricloracético: casi no se usa. Su única ventaja radica en que puede usarse en
caso de mujeres embarazadas.
NOTA: todos los tratamientos tópicos son para uso exclusivamente externo, es
decir no los podemos utilizar si la enfermedad afecta al recto o vagina.
Crioterapia
La
crioterapia consiste en la utilización de nitrógeno líquido para quemar por
frío las verrugas sexuales. Requiere la utilización de una “pistola”
especialmente diseñada que pulverizar de forma selectiva sobre las lesiones a
tratar. Muy eficaz, de fácil manejo, es un buen método para el manejo de
verrugas recidivantes después de un tratamiento quirúrgico.
Cirugía
Es
el tratamiento de elección cuando las lesiones son internas, es decir en
territorio de mucosa (en el interior del recto o de la vagina en la mujer) ya
que son zonas donde está contraindicado el uso de las pomadas tópicas por su
toxicidad sistémica. El tipo de anestesia a utilizar depende de la superficie a
tratar. Puede ser local, regional/epidural o incluso general. Las verrugas se
pueden cauterizar usando un bisturí eléctrico convencional o un láser de CO2.
Yo recomiendo el segundo ya que el daño térmico que produce sobre las zonas
sanas adyacentes es mucho menor.
Vacunas
La
FDA ratificó la vacuna contra el VPH y estableció que es segura para los
hombres y mujeres de 9 a 26 años de edad. La vacuna se aplica en tres
inyecciones en un lapso de 6 meses. La vacunación preventiva contra el HPV es de
vital importancia. En el Perú disponemos de dos opciones comerciales:
·
Gardasil
(Sanofi-Pasteur-MSD): Vacuna
tetravalente, protege frente a cepas 6/11/16/18
·
Cervarix
(Glaxo Smith Kline): Vacuna
bivalente, protege frente a cepas 16/18
Como
se puede apreciar de lo anterior, las vacunas no protegen contra todos los
tipos de VPH, por lo que es importante que las personas sexualmente activas se
hagan controles de rutina y que las jóvenes se hagan una prueba de Papanicolaou
cuando su médico lo recomiende.
Gardasil
y Cervarix están diseñados para provocar las respuestas de los anticuerpos que
neutralizan el virus y previenen la infección inicial con los tipos de VPH
representados en las vacunas. Se ha demostrado que ofrecen 100% de protección
contra el desarrollo precanceroso cervical y, en el caso de la tetravalente,
también frente las verrugas genitales causadas por los tipos de VPH en la
vacuna, con pocos o ningún efecto secundario. Se espera que los efectos
protectores de la vacuna duren al menos 4,5 años después de la vacunación
inicial.
La
única manera de prevenir completamente las infecciones por el VPH y otras ETS
es no tener relaciones sexuales (lo que se conoce como abstinencia). Para las
personas sexualmente activas, los condones ofrecen cierto grado de protección
contra el VPH. Los condones no pueden prevenir completamente las infecciones
porque las verrugas pueden encontrarse fuera del área cubierta por el condón
(estas verrugas no siempre pueden verse a simple vista) y además los condones
pueden romperse.
La
vacuna contra el VPH tampoco puede reemplazar el uso de condones para
protegerse contra otras ETS durante el acto sexual.
Las
espumas, cremas y geles espermicidas tampoco protegen contra el VPH ni las
verrugas genitales. Si tiene preguntas sobre la vacuna o inquietudes sobre las
ETS, hable con su médico.
Efectos secundarios tras la aplicación
de las vacunas
La
mayoría de los efectos secundarios que presentan las personas por la vacuna
contra el VPH son leves, como dolor o hinchazón en el lugar de la aplicación o
debilidad posterior a la vacunación. Al igual que con otras vacunas, hay un
pequeña probabilidad de tener una reacción alérgica.
Pocas
personas han informado haber tenido problemas de salud después de vacunarse. La
FDA está haciendo controles estrictos de la vacuna para asegurarse de que estas
reacciones no se deban a la vacuna misma.
La
mayoría de las personas no tienen problemas con la vacuna. Para reducir el
riesgo de presentar efectos secundarios como desmayos, es conveniente
permanecer sentado por 15 minutos después de cada aplicación de la vacuna.
Las
vacunas frente a HPV son preventivas, no curativas. Su aplicación protege
contra la aparición de displasias cervicales así como de verrugas genitales. Su
uso en varones es un tema todavía controvertido. Se cree que el efecto
protector de la misma podría ser menor ya que el aparato reproductor del varón
esta menos expuesto por tener menos zonas húmedas. Sin embargo, el aumento
vertiginoso de las cifras de cáncer de ano y recto entre la población
homosexual masculina ha planteado seriamente la posibilidad de sugerir la
vacunación preventiva para dicho colectivo.
8.- El VPH y el cáncer
El VPH y el cáncer en las mujeres
Casi
todos los cánceres de cuello uterino (más del 99%) están conexos con el VPH. De
estos casos, alrededor del 70% son causados por los tipos de VPH 16 o 18.
Los
cambios de bajo grado en las células del cuello uterino son originados por un
número de tipos de VPH. Con más frecuencia, los cambios de bajo grado
desaparecen sin tratamiento, pero si crecen hasta convertirse en verrugas los
médicos pueden eliminarlas. Sin embargo, los cambios de bajo grado también
pueden ser causados por tipos de VPH de alto riesgo, no sólo por los de bajo
riesgo. Los médicos que encuentran cambios de bajo grado a menudo realizan más
pruebas.
En
los estudios de investigación, la mayoría de las personas que dieron positivo
al VPH genital darán negativo en una prueba futura, a menudo dentro de 6 a 12
meses. Los científicos aún no están seguros si esto significa que el sistema
inmunológico de una persona ha destruido todo el VPH o si sólo ha suprimido la
infección a un nivel extremadamente bajo (demasiado bajo como para ser
detectado mediante pruebas). Si incluso unas pocas células del cuello uterino
aún tienen el VPH, es posible que el virus se torne activo nuevamente si su
sistema inmunológico se debilita mucho.
Los
cambios en las células del cuello uterino pueden ocurrir repentinamente muchos
años después de la exposición al VPH. Puede que estos cambios sean de bajo
grado o de alto grado. Este retraso ayuda a explicar cómo una mujer podría
presentar cambios en las células del cuello uterino después de muchos años de
pruebas normales de Papanicolaou y sin una nueva pareja sexual.
Si
las células cervicales permanecen infectadas con el VPH, el virus puede causar
que las células cambien y se vuelvan precancerosas. A los posibles cambios
celulares precancerosos vistos en una prueba de Papanicolaou se les llama ASC
(células escamosas atípicas) y SIL (lesiones intraepiteliales escamosas).
La
ASC se divide en:
• ASC-US
(células escamosas atípicas de importancia incierta), los cuales tienen una
baja probabilidad de ser precancerosos.
y
• ASC-H
(células escamosas atípicas, no se puede descartar una lesión de alto grado)
que tienen una mayor probabilidad de ser precancerosos.
Si
una prueba de Papanicolaou muestra ASC-US, el médico pudiera hacer una prueba
de VPH o simplemente repetir la prueba de Papanicolaou en 6 meses.
Por
otro lado, si la prueba de Papanicolaou muestra ASC-H, se realizará una
colposcopia para examinar el cuello uterino, y se realizará una biopsia de
cualquier área anormal.
Si
se observa SIL, se realizará una colposcopia para examinar el cuello uterino, y
se realizará una biopsia de cualquier área anormal.
A
un pre cáncer que se descubre por una biopsia se le llama CIN (neoplasia
intraepitelial cervical).
Aun
así, muy pocas infecciones por el VPH pueden originar cáncer de cuello uterino.
Mediante las pruebas periódicas de Papanicolaou y de VPH, se pueden detectar
las células precancerosas antes de que tengan la oportunidad de crecer hasta
convertirse en cáncer.
Otros tipos de cáncer y VPH
Cerca
de nueve de cada diez casos de cáncer anal de células escamosas son causados
por el VPH-16 o VPH-18, los mismos tipos de VPH genital que causan la mayoría
de los casos de cáncer de cuello uterino. Casi la mitad de los cánceres de
vulva y alrededor de siete de cada diez cánceres de la vagina están vinculados
con el VPH. Algunos otros cánceres genitales (cánceres de pene y uretra) y
algunos cánceres de cabeza y cuello (principalmente de la garganta y las
amígdalas) también están asociados con los tipos de VPH de alto riesgo. Además,
muchas de las personas con cáncer de piel y cuyos sistemas inmunológicos están
debilitados, son portadoras del VPH.
Los hombres y el cáncer por VPH
El
VPH ha sido vinculado a ciertas clases de cánceres de cabeza y cuello tanto en
hombres como en mujeres. Además, algunos tipos de VPH han estado asociados con
el cáncer de pene y de ano en los hombres. El cáncer de pene es poco común,
pero actualmente el cáncer anal es casi tan común en los hombres y en las
mujeres que tienen sexo anal como lo era el cáncer de cuello uterino en las
mujeres antes de que se pusiera en práctica la prueba de Papanicolaou. Aun
cuando el sexo anal aumenta en gran manera el riesgo de una persona de cáncer
anal, el sexo anal no es la única manera de contraer VPH anal o de desarrollar
cáncer anal.
Al
igual que las mujeres, los hombres no presentan síntomas del VPH a menos que
tengan un tipo que causa las verrugas genitales. En los hombres, las verrugas
genitales pueden aparecer alrededor del ano o en el pene, el escroto, la ingle
o los muslos.
Actualmente,
no existe una prueba aprobada para detectar el VPH en los hombres. No obstante,
las verrugas genitales pueden ser detectadas y tratadas.
Contrario
a las mujeres que cuentan con la prueba de Papanicolaou para detectar temprano
los cánceres de cuello uterino asociados con el VPH, no existen pruebas
aprobadas para detectar temprano los cánceres anales en hombres o mujeres. Las
pruebas para detectar cáncer anal se han estado estudiando en algunas personas
con alto riesgo de este cáncer, como aquéllas que son homosexuales o bisexuales
y aquéllas infectadas con VIH. Hasta la fecha, ninguna de esas pruebas ha
probado funcionar lo suficientemente bien como para ser recomendada para uso de
rutina.
REFERENCIAS
1.
Virus del
papiloma humano. Situación actual, vacunas y perspectivas de su utilización».
Comisión de Salud Pública/Consejo Interterritorial del Sistema Nacional de
Salud (febrero 2007).
2.
http://peru21.pe/vida21/cerca-300000-mujeres-lima-infectadas-virus-papiloma-humano-2165991
3. Infección genital por VPH - CDC Fact Sheet en español».
Centers
for Disease Control and Prevention (CDC) (24 oct 2008). Consultado el 25 ene
2010.
4. Schiffman M, Castle
PE (August 2003). «Human papillomavirus: epidemiology and public health».
Archives of Pathology & Laboratory Medicine 127 (8): pp. 930-934. PMID 12873163.
5. Walboomers JM,
Jacobs MV, Manos MM (1999). «Human papillomavirus is a necessary cause of
invasive cervical cancer worldwide». J. Pathol. 189 (1): pp. 12-19. Doi: 10.1002/ (SICI) 1096-9896(199909)189:1<12: aid-path431="">3.0.CO;2-F. PMID 10451482.
6. Goldstein MA,
Goodman A, Del Carmen MG, Wilbur DC (March 2009). «Case records of the
Massachusetts General Hospital. Case 10-2009. A 23-year-old woman with an
abnormal papanicolaou smear». N. Engl. J. Med. 360 (13): pp. 1337-1344. Doi: 10.1056/NEJMcpc0810837.
PMID 19321871. PMID 19321871
7. Kahn JA (July
2009). «HPV vaccination for the prevention of cervical intraepithelial
neoplasia». N. Engl. J. Med. 361 (3):
pp. 271-278. Doi: 10.1056/NEJMct0806938. PMID 19605832. PMID 19605832
8.
«NCCC National Cervical Cancer Coalition». Consultado el 1 de julio de 2008.
9. Ir a ↑ Lowy DR,
Schiller JT (2006). «Prophylactic human papillomavirus vaccines». J. Clin.
Invest. 116 (5): pp. 1167-1173. Doi:
10.1172/JCI28607. PMID 16670757.
11.
Dunne EF, Unger ER, Sternberg M, et al (2007). «Prevalencia de la infección a VPH entre mujeres de
Estados Unidos». JAMA 297 (8): pp. 813-9.
doi:10.1001/jama.297.8.813. PMID 17327523.
12.
Hillard Weinstock, Stuart Berman and Willard Cates,
Jr. (January/February 2004). «Sexually Transmitted Diseases Among American
Youth: Incidence and Prevalence Estimates, 2000». Perspectives on Sexual and
Reproductive Health 36 (1): pp. 6. Doi:
10.1363/3600604. PMID 14982671.
13.
Baseman JG,
Koutsky LA (2005). «The epidemiology of human papillomavirus infections». J. Clin. Virol.
32 Suppl 1: pp. S16-24.
14.
«American Social Health Association - HPV Resource
Center». Consultado el 17 de agosto 2007.
15.
Revzina NV,
Diclemente RJ (2005). «Prevalencia e incidencia de la infección por
papilomavirus humano en mujeres en Estados Unidos: una revisión sistemática». International
journal of STD & AIDS 16 (8): pp.
528-37.
16.
McCullough, Marie
(28 de febrero 2007). Razas de virus de cáncer más raras que las primeras
estimaciones. The Philadelphia Inquirer. Consultado el 2 de marzo de 2007.
17.
Brown, David (28
de febrero 2007). Los estudios encuentran a más mujeres de lo esperado con VPH.
San Francisco Chronicle. Consultado el 2 de marzo de 2007. (Publicado
originalmente en el Washington Post como «More american women have HPV than
previously thought»)
18.
Kumar, MBBS, MD, FRCPath, V.; Abul K. Abbas, MBBS,
Nelson Fausto, MD and Jon Aster, MD. «Cervix: premalignant and malignant
neoplasms». En Saunders (Elsevier). Robbins & Cotran Pathologic Basis of
Disease (8th edición). ISBN
978-1-4160-3121-5.
19.
«Hechos
estadísticos entre VPH y hombres». Consultado el 17 agosto 2007.
20.
Frisch M, Smith E, Grulich A, Johansen C (2003). «Cáncer en una cohorte poblacional de hombres y
mujeres con parejas registradas homosexuales». Am. J. Epidemiol. 157 (11): pp.
966-72. PMID 12777359.
21.
Dunne EF, Nielson CM, Stone KM, Markowitz LE, Giuliano
AR (2006). «Prevalencia de la infección
por VPH entre hombres: revisión sistemática de la literatura». J. Infect. Dis.
194 (8): pp. 1044-57. doi: 10.1086/507432. PMID 16991079.
22.
«WebMD».
Consultado el 17 agosto 2007.
23.
Dunne EF, Unger ER, Sternberg M (February 2007).
«Prevalence of HPV infection among females in the United States». JAMA: the
journal of the American Medical Association 297 (8): pp. 813-819. doi:10.1001/jama.297.8.813. PMID 17327523.
24.
«STD Facts - VPH Vaccine» (1 agosto 2006). Consultado el 17 agosto 2007.
25.
«What Are the Key Statistics About Cervical Cancer? ».
American Cancer Society (28 de octubre de
2009). Consultado el 04-12-2009.
26.
Acheson, Nicholas
H. «Ch.11
Papillomaviruses». Fundamentals of Molecular Virology (1st edición). John Wiley
& Sons Inc. ISBN 0-471-35151-2.
27.
Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson;
Mitchell, Richard (2007). «Chapter 19 the Female Genital System and Breast».
Robbins Basic Pathology (8 edición). Philadelphia: Saunders. ISBN
1-4160-2973-7.
28.
Muñoza N,
Castellsaguéb X, Berrington de Gonzálezc A, Gissmann L (2006). «Chapter 1: HPV in
the etiology of human cancer». Vaccine 24
(3): pp. S1-S10. doi:10.1016/j.vaccine.2006.05.115. PMID 16949995.
29.
Greer CE, Wheeler CM, Ladner MB, et al (1995). «Distribución de tipo de papilomavirus humano (VPH), y
respuesta serológica a partículas de virus VPH tipo 6 en pacientes con verrugas
genitales». J. Clin. Microbiol. 33 (8): pp. 2058-63. PMID 7559948.
30.
«Virus del
papiloma humano genital (VPH) - Hoja informativa de los CDC», artículo en el
sitio web de los CDC (Centros para el Control y la Prevención de Enfermedades)
del 5 de mayo de 2011, consultado el 4 de octubre de 2011.
31.
«Glaxo cervical
cáncer shot approved in Australia», artículo de Reuters en inglés, 2007-05-21;
consultado el 2007-05-25.
32.
Casado Buesa MI,
García Hernández L, González Enríquez J, Imaz Iglesia I, Rubio González B,
Zegarra Salas P. Evaluación económica de la introducción de la vacuna contra
VPH en España para la prevención del cáncer de cuello uterino. Informe Público
de Evaluación de Tecnologías Sanitarias IPE 2012/69. Madrid: Agencia de
Evaluación de Tecnologías Sanitarias; diciembre de 2012. N.I.P.O. en línea:
725–12–053–X
33.
«El Consejo
Interterritorial aprueba la inclusión de la vacuna del virus del papiloma
humano en el calendario vacunal del SNS por unanimidad», nota de prensa del
Ministerio de Sanidad, Política Social e Igualdad (de España), del 10 de
octubre de 2007.
34.
«El gobierno
autoriza la vacuna contra el papiloma humano», artículo en El País (Madrid) del
24 de agosto de 2007.
35.
«¿Who invented
the VLP cervical cáncer vaccines?», historia del descubrimiento de la vacuna,
descrita por C. McNeil en el Journal of the National Cáncer Institute (EE.
UU.), 2006, 98 (7): pág. 433.
36.
«Sustained efficacy up to 4.5 years of a bivalent L1
virus-like particle vaccine against human papillomavirus types 16 and 18:
follow-up from a randomised control trial», artículo en la revista Lancet, 367
(9518): págs. 1247-1255, 15 de abril de
2006.
37.
«FDA licenses new
vaccine for prevention of cervical cáncer and other diseases in females caused
by human papillomavirus», artículo en el sitio web de la FDA del 8 de junio de
2006; consultado el 4 de febrero de 2007.
38.
« ¿Su hija está
protegida contra el cáncer de cuello uterino?», artículo en el sitio web de los
CDC (Centros para el Control y la Prevención de Enfermedades); consultado el 4
de octubre de 2011.
39.
«Prophylactic human papillomavirus vaccines», artículo
en Journal of Clinical Investigation.
40.
«Virus del
papiloma humano. Situación actual, vacunas y perspectivas de su utilización»,
artículo en el sitio web de la Comisión de Salud Pública, del Ministerio de
Sanidad y Consumo (de España); del 20 de febrero de 2007.
41.
«New data show
Cervarix™, GlaxoSmithKline’s HPV 16/18 cervical cáncer candidate vaccine, is
highly immunogenic and well-tolerated in women over 25 years of age», artículo
en el sitio web de la empresa Glaxo Smith & Kline, del 5 de junio de 2006;
consultado el 27 de enero de 2007.
42.
«Cervarix(TM)»,
artículo en el sitio web de la Universidad Emory (EE. UU.) Del 21 de agosto de
2006; consultado el 27 de enero de 2007.




.jpg)









Buenas tardes, soy de trujillo y estoy buscando la podifilina, pero no encuentro en ninguna farmacia, quisiera que me ayude brindándome la información necesario para encontrarlo, muchas gracias
ResponderEliminarQuisiera me recomiende algun medico o algun lugar para atenderme por condilomas anales.
ResponderEliminarQue hospitales o clínicas pueden contar con el láser co2 tengo consumo más peor internos y es gran molestia al momento de ir al baño
ResponderEliminarQue hospitales o clínicas pueden contar con el láser co2 tengo consumo más peor internos y es gran molestia al momento de ir al baño
ResponderEliminarDonde esta la clinica
ResponderEliminarTodavía no puedo creer que no sé por dónde empezar, me llamo Juan, tengo 36 años, me diagnosticaron herpes genital, perdí toda esperanza en la vida, pero como cualquier otro seguí buscando un cura incluso en Internet y ahí es donde conocí al Dr. Ogala. No podía creerlo al principio, pero también mi conmoción después de la administración de sus medicamentos a base de hierbas. Estoy tan feliz de decir que ahora estoy curado. Necesito compartir este milagro. experiencia, así que les digo a todos los demás con enfermedades de herpes genital, por favor, para una vida mejor y un mejor medio ambiente, por favor comuníquese con el Dr. ogala por correo electrónico: ogalasolutiontemple@gmail.com también puede llamar o WhatsApp +2348052394128
ResponderEliminar